(14分)氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。⑴写出氨气与氧化铜反应的化学方程
问题描述:
(14分)氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去)。回答下列问题。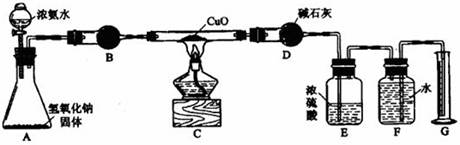 ⑴写出氨气与氧化铜反应的化学方程式。⑵在A的锥形瓶中放入NaOH固体的目的是。⑶在干燥管B里不能选用的干燥剂是(填序号)。 A 碱石灰 B 生石灰 C 五氧化二磷 D 氢氧化钠⑷在C的玻管中观察到的现象是 。⑸E装置中盛装浓硫酸的目的是 。⑹待实验完毕后,若实验测得N 2 的体积(折算成标准状况)为aL,则被还原的氧化铜的物质的量为 mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为 。(用含a、b字母的代数式表示) ⑴写出氨气与氧化铜反应的化学方程式。⑵在A的锥形瓶中放入NaOH固体的目的是。⑶在干燥管B里不能选用的干燥剂是(填序号)。 A 碱石灰 B 生石灰 C 五氧化二磷 D 氢氧化钠⑷在C的玻管中观察到的现象是 。⑸E装置中盛装浓硫酸的目的是 。⑹待实验完毕后,若实验测得N 2 的体积(折算成标准状况)为aL,则被还原的氧化铜的物质的量为 mol;若测得干燥管D增重bg,则氨分子中氮、氢的原子个数比为 。(用含a、b字母的代数式表示) |
 最佳答案:
最佳答案: ⑴2NH 3 +3CuO N 2 +3Cu+3H 2 O (2分)⑵NaOH固体吸水及溶解产生的热利于氨气的逸出。(2分)⑶C (2分)⑷黑色粉末变为光亮的红色固体。(2分)⑸将反应剩余的氨吸收,防止F中的水蒸气进入D中,引起测量误差。(2分)⑹3a/22.4(2分) 9a/11.2b(2分) N 2 +3Cu+3H 2 O (2分)⑵NaOH固体吸水及溶解产生的热利于氨气的逸出。(2分)⑶C (2分)⑷黑色粉末变为光亮的红色固体。(2分)⑸将反应剩余的氨吸收,防止F中的水蒸气进入D中,引起测量误差。(2分)⑹3a/22.4(2分) 9a/11.2b(2分) |
考查氨气的制取与性质、分子组成的测定;实验目的之一是测定氨分子的组成,结合所给装置可看出,通过氨气还原氧化铜,氮元素转化为氮气,可用排水法来测定其体积,而氢元素转化为水,其质量可通过装置D的增重来测得。(1)氨气中的氮元素为其最低负价,可将氧化铜还原:2NH 3 +3CuO N 2 +3Cu+3H 2 O(2)此为简易法来制备氨气;在氨水中存在平衡:NH 4 + +OH- N 2 +3Cu+3H 2 O(2)此为简易法来制备氨气;在氨水中存在平衡:NH 4 + +OH- NH 3 ·H 2 O NH 3 ·H 2 O NH 3 +H 2 ONaOH固体溶解产生大量的热且可产生大量的OH - ,均可促使氨气的生成与逸出:NH 3 ·H 2 O NH 3 +H 2 ONaOH固体溶解产生大量的热且可产生大量的OH - ,均可促使氨气的生成与逸出:NH 3 ·H 2 O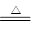 NH 3 ↑+H 2 O(3)氨所碱性氧化,不能用酸性干燥剂来干燥,故答案为C(4)氧化铜为黑色粉末,被氨气还原为红色的金属铜(5)为保证装置D只吸收反应所生成的水,可知装置E主要有两个作用,一是吸收未反应的氨气,二是防止装置F中的水气进入装置E中(6)氨气的物质的量为a/22.4 mol,由化学方程式可知,被还原的氧化铜的物质的量为3a/22.4 mol;水的物质的量为b/18 mol;所以氨分子中氮、氢的原子个数比为 NH 3 ↑+H 2 O(3)氨所碱性氧化,不能用酸性干燥剂来干燥,故答案为C(4)氧化铜为黑色粉末,被氨气还原为红色的金属铜(5)为保证装置D只吸收反应所生成的水,可知装置E主要有两个作用,一是吸收未反应的氨气,二是防止装置F中的水气进入装置E中(6)氨气的物质的量为a/22.4 mol,由化学方程式可知,被还原的氧化铜的物质的量为3a/22.4 mol;水的物质的量为b/18 mol;所以氨分子中氮、氢的原子个数比为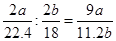 |
版权声明
声明:有的资源均来自网络转载,版权归原作者所有,如有侵犯到您的权益
请联系本站我们将配合处理!
